尿素を通してみる化学物質と人間生活とのかかわり
大阪府教育センター 理科第一室 平田 允
1 はじめに
「理科基礎」の目標は人類がこれまで自然の謎の探究や解明にどのように挑戦し文明の発展に寄与してきたかについて学ぶことにある1)。このため、自然科学の発展に関係のある主な発明・発見や原理・法則及び学説などの中から典型的な事例を取り上げ、過去の実験を再現したり、科学が直面している課題、科学と人間生活とのかかわりなどを考察することとしており、指導の重点は次のような点にあると思われる。
・ 多くの事項や事例を羅列的に扱うのではなく、科学の歴史の中で画期的な転換となった典型的な 事例を取り上げ、新しい発見や学説の登場によってこれまで正しいと信じられてきた古い学説が修 正されたり、否定されたりする過程を学ぶことを通じて、人類がどのようにして自然の謎の探究・ 解明を行ってきたかを理解させる。
・ 科学の発展の過程の中で発生してくる問題に対応し、それを克服してゆくことが将来に向けて人 類の夢を叶えることになるということを理解させるとともに、科学技術の発展により生じる自然環 境への問題をも考えさせ、自然環境やエネルギー問題等と調和のとれた科学の発展を考えさせる。
・ 科学に対する興味・関心を一層高め、併せて自然を調べる能力や態度を育成し問題解決の能力を 身に付けさせる。
以上のような点を指導の中心にすることを考慮し、「物質の合成への道」の単元の教材として、多くの教科書で採用されると予想される「尿素」を取り上げ、尿素が合成されるに至った歴史的な経緯や、尿素が人間生活にどのように利用されているかをいくつかの事例を示して解説するとともに、関連する観察や実験を紹介した。
2 尿素の生体内での生成
尿素(NH2CONH2)は人や動物の体内で、主にタンパク質が代謝されるときに生じる物質である。我々の身体を構成するタンパク質の1〜2%が毎日分解されている。そのうちの75〜80%は、再びタンパク質合成に利用され、残りはエネルギ−等に使用される。このため、成人では一日60〜70gのタンパク質が必要だといわれている。食事等で体内に取り込まれたタンパク質はアミノ酸やペプチドに分解されて、腸管から吸収される。吸収されたアミノ酸やペプチドは酵素や細胞などの生体に必要なタンパク質に再合成され、体内の組織内で様々な形で利用される。その後、不要となった分は分解されてアンモニアとなる。このアンモニアは生体にとって有毒であるので、主に肝臓で尿素回路2)と呼ばれる経路で尿素に変えられる。こうして生成した尿素は腎臓に運ばれ尿とともに排泄される。成人では一日に約30gの尿素を排出しているといわれている。一般的に筋肉1kgが崩壊すると40gの尿素が生じるとされている。
3 尿素の人工合成
前述のように、尿素は生物体内の生理作用によって生成するものであって、実験室で人工的に合成できないものとされていた。しかし、この考えは、1828年にドイツ人の化学者ウェーラーが尿素を実験室で合成したと発表したことによって、大きく転換されることになった3) 。当時、ウェーラーはシアン化合物に関心をもっており4)、1824年にプラウトが尿素に与えた実験式(CH4ON2)とウェーラーがシアン酸アンモニウムに予想していた式が同一であることから、シアン酸アンモニウム(NHOCN)を作るために、シアン酸銀(AgOCN)に塩化アンモニウム(NH4Cl)の水溶液を加えて加熱したり、シアン酸鉛(Pb(OCN))とアンモニア水の混合物を熱したりして、結晶性の白色物質を得た。こうして得られた物質を調べたところ、シアン酸アンモニウムの性質を示さなかった。例えば、シアン酸アンモニウムであれば、溶液に硝酸銀(AgNO3)水溶液を加えると(1)の反応によって、白色の沈殿が生成するはずである。また、水酸化カリウム水溶液を加えると(2)の反応によって、アンモニアが発生するはずである。
NH4OCN + AgNO3 → AgOCN ↓ + NH4NO3 (1)
NH4OCN + KOH → NH3 + KOCN + H2O (2)
しかし、この物質は硝酸銀によって沈殿を生成することもなく、水酸化カリウム水溶液を加えてもアンモニアの臭気は出なかった。
 図1 ウェーラー
図1 ウェーラー
ウェーラーはこの白色物質が、シアン酸とアンモニアを結合させようと試みるときにはいつも生成することを見出した。そこで、この物質をいろいろ調べたところ、この物質はウェーラーがかつて、人間や犬の尿の成分を研究したときに分離した尿素に似ていることが判明した。ウェーラーは尿より分離した純粋な尿素との比較実験を実施し、燃焼によって生成する窒素と二酸化炭素の体積比や元素分析の結果がプラウトらが発表している尿素の測定値と一致することから、この結晶物質は尿素であることを確認した。
当時の化学者間では、尿素等の化合物は有機化合物と呼ばれ、生命が作り出す物質群であり、無機化合物から人工的に合成することはできないという「生気論」が信じられていた。しかし、無機化合物であるシアン酸とアンモニアを結合させると尿素が得られるという事実は、当時の学会の常識をくつがえすものであった。
ウェーラーはベルセリウスに宛てた手紙で「私は、人であれ犬であれ、ともかく腎臓を必要とせずに尿素を作ることができました。」と書いている。ウェーラーはこの結果を1828年に「無機物質から有機物質の人工的生成の一例」として、発表したが、どのような有機化合物でも無機物からの合成が可能であるという一般化を引き出すことはしなかった。これはウェーラーがシアン酸塩を得るための出発物質が動物の血液や角などを用いて作られる黄血塩(ヘキサシアノ鉄(?)酸カリウム:K4Fe(CN)6)であるため、生命力によって生じたと考えられる物質から出発している点が気がかりであったからと思われる。そのため、ウェーラーは尿素合成は無機物からの合成ではないという一部の人々の主張を認め、あえて生気論の考えを否定しようとはしなかった。
しかし、この発表がきっかけとなって、それまで不可能として着手されなかった無機化合物による有機化合物の合成が多くの研究者によって始められ、有機化学の大きな転換点となったことは事実である。
【観察・実験1】 シアン酸塩からの尿素の合成
多くの化学関係の書籍には、「ウェーラーはシアン酸アンモニウムを加熱して、尿素を合成した」と記述されているが、シアン酸アンモニウムの性質を考えると、シアン酸アンモニウムから尿素を合成したのではなく、前述のように、「シアン酸アンモニウムを製造しようとして、シアン酸塩にいろいろな操作を加えた結果、シアン酸アンモニウムは得られず、尿素が得られた。」と考えるべきである。このことから、ここでは、歴史的に有名な物質の合成実験の例として、シアン酸カリウム(KOCN)と硫酸アンモニウム((NH4)2SO4)の混合溶液を加熱することにより尿素を合成する。
2KOCN + (NH4)2SO4 → 2NH4OCN + K2SO4 → 2NH2CONH2 + K2SO4 (3)
[操 作]
? シアン酸カリウム4gと硫酸アンモニウム3.3gを蒸発皿に取り、水50mlを加えて溶解させる。
? 溶液の一部を試験管に取り、1%AgNO3水溶液数滴を加える。白い沈殿ができることを確認する。
KOCN + AgNO3 → AgOCN↓(白沈)+ KNO3 (4)
? ?の溶液2mlを比較試料として、試験管に取った後、?の溶液をウオータバス上で加熱する。
? 加熱前の比較試料溶液2mlと5分加熱後及び10分加熱後の溶液2mlをそれぞれ別の試験管に取 り、それぞれの試験管に2mol/lNaOH水溶液1滴と5%CuSO4水溶液1滴を加えて変化を 見る。加熱前の試料は濃青色に着色するのに対し、加熱後の試料は赤紫色に着色する。(注1)
? 加熱を続け、液がなくなるまで注意深くかくはんしながら濃縮し、析出した結晶を三角フラスコ に移して、無水アルコール100mlを加えて、加熱しろ過する。アルコールに不溶の硫酸カリウム はろ紙上に残る。
? ろ液を濃縮すると、尿素の結晶が得られる。
(注1)この発色は加熱前の試料ではアンモニウムイオンによる銅アンミン錯イオンによる濃青色で、加熱後は生成した尿素が溶液中のシアン酸イオンとさらに反応して二次的に生成したビウレット(NH2CONHCONH2)によるビウレット反応*1の発色である。この方法では直接尿素の存在を確認していないが、変化が簡単に観察できる利点がある。もし、直接尿素の存在を確認するのであれば、試料溶液に3mol/l硫酸溶液0.5mlと10%p-ジメチルアミノベンズアルデヒドのアルコール溶液1,2滴を加えて、黄色の発色を確認する方法がある。
*1 ビウレット反応:1個の炭素原子を隔てて結合している2個のCONH基がCu2+イオンと錯 塩を形成し、赤紫色を呈する反応。
【観察・実験2】 ウレアーゼによる尿素の分解
ウレアーゼは尿素を二酸化炭素(CO2)とアンモニア(NH3)に分解する酵素である。
NH2CONH2 + H2O → CO2 + 2NH3 (5)
酵素は生体内反応に触媒作用を示すタンパク質で、作用する物質が特定されているという特徴がある。したがって、ウレアーゼは尿素の分解反応には関与するが、尿素以外の物質に対してはたとえ構造が似ていても関与しない。この性質を利用して、尿素の定量に利用されている5)。ウレアーゼは生体内に存在するが、天然には豆類特にナタ豆に多く含まれている。乾燥大豆にも8×10-3%程度含まれている6)ので、大豆中のウレアーゼを利用して、尿素の分解反応を構造がよく似たビウレット(NH2CONHCONH2)と比較させて観察する。
[操 作]
? ウレアーゼ溶液の調整
乾燥大豆3gを水に浸けて柔らかくし、乳鉢ですりつぶす。純水100mlを加えてかくはんし、 ガーゼでこし、得られた乳白色の溶液をウレアーゼ溶液とする。
? 1%尿素溶液と1%ビウレット溶液50mlをそれぞれ別の100mlビーカに取り、フェノールフ タレン指示薬数滴を加えた後、ウレアーゼ溶液1mlを加えて、変化を観察する。
? 尿素溶液は分解反応が進んで、アンモニアが生成するため、溶液がアルカリ性となり、フェノー ルフタレン指示薬が赤く変色するが、ビウレット溶液は変化が起こらないことが分かる。
? 直接アンモニアの生成を確認するには、試料溶液をネスラー試験紙*2につけて、変色を確認するとよい。
*2 ネスラー試薬は水銀化合物が含まれているので、使用・廃棄には細心の注意をすること。
4 尿素の工業的製法
現在、尿素は我が国では年間約50万トン生産されている重要な化学製品であり、主に肥料及び合成樹脂などの原料として使用されている。
工業的に尿素を製造する方法7)はアンモニアと炭酸ガスを反応させてアンモニウムカルバメート(NH2COONH4)を生成させ、これを分解させて尿素を得ている。
2NH3+ CO2 → NH2COONH4 (6)
NH2COONH4 → NH2CONH2 + H2O (7)
工業的製造法は非循環式、半循環式(炭酸ガス吸収式、アンモニア吸収式)、完全循環式がある。
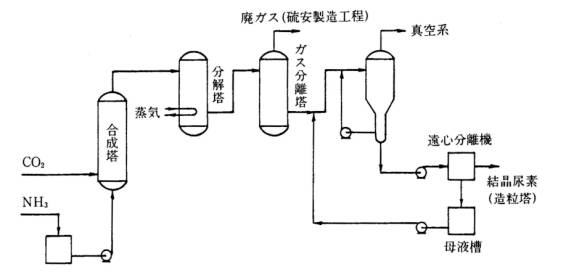 図2 尿素製造プロセス
図2 尿素製造プロセス
非循環式の製造プロセスでは、原料の炭酸ガスを圧縮機で加圧し、アンモニアは液体アンモニアをポンプで加圧して、合成塔に送入し、170〜220℃,150〜400atm(1.52〜4.05×107Pa)の下で反応させる。この合成塔で生成したアンモニウムカルバメートは分解塔で尿素に分解されたのち、ガス分離塔に入る。ガス分離塔で未反応のアンモニアと炭酸ガスが分離され、製品の尿素は水溶液で得られるので、結晶缶に送って、濃縮晶析させる。結晶は遠心分離器で脱水後、造粒塔で粒状尿素を製造する。
5 肥料としての尿素の利用
植物は主に根を通して水分とともに必要な養分や無機物を吸収している。植物に特に必要な養分は窒素、燐酸、カリであり、これを肥料の三要素と呼んでいる。
尿素は窒素肥料としての窒素含有量が硫安(硫酸アンモニウム(NH4)2SO4:21.2%)や硝安(硝酸アンモニウム NH4NO3:41.1%)に比べて46.6%と高く、結晶または粒状で取扱いや保存に便利である。しかも、土壌を酸性化させる酸根がないので、即効性の中性肥料として利用されている。欠点として、尿素は吸湿性が強いので、その点を改良することと、遅効性化を目的として、尿素をホルムアルデヒドと酸触媒下で反応させた、モノメチロール尿素(NH2CONHCH2OH)やメチレン二尿素(NH2CONHCH2NHCONH)のような誘導体が開発され、ウレアホーム等の名称で遅効性・難溶性肥料として用いられている。
6 尿素樹脂
プラスチックは家庭用品を始めとして、電気製品、自動車、住宅、レジャー用品等あらゆる分野で使用され、我々の生活になくてはならないものとなっている。これらのプラスチックは現在その用途に応じて多くの種類のものが作られているが、プラスチックの第一号は1909年にアメリカで活躍していたベルギーの化学者L.H.ベークランドがフェノール(C6H5OH)とホルムアルデヒド(HCHO)を付加縮合させて製造したフェノール樹脂である8)。ベークランドは工場を設立し、「ベークライト」の商品名で工業化をスタートさせた。フェノール樹脂はすぐれた電気絶縁性と耐熱性、成型加工性をもっており、当時急速に拡大しつつあった電機産業に支えられる形でその需用を増大させていった。
フェノール樹脂はもともと透明な赤褐色をしているため、製品が黒や茶褐色となり、自由な着色ができないことと、フェーノール臭が発生する欠点があった。この欠点を解決する材料として開発されたプラスチックが尿素樹脂である。尿素樹脂は尿素とホルムアルデヒドを重合させたもので、反応はフェノール樹脂と同様、尿素とホルムアルデヒドより水分子が取れて結合する付加縮合である9)。
付加 H2NCONH2 + HCHO → H2NCONHCH2OH (8)
縮合 H2NCONHCH2OH + H2NCONH2 → HNCONHCH2NHCONH2 + H2O (9)
尿素のアミノ基にはホルムアルデヒドと結合可能な水素が4個あるため、工業的にはアルカリを触媒として、トリメチロール尿素、テトラメチロール尿素を生成させ、得られた液体にパルプなどの充填剤を混ぜて、成形機に入れ加熱圧縮して硬化させる。
硬化反応は、縮合反応が三次元的に次々と起こり、三次元の立体構造をもつ高分子となる。このように三次元網状構造を作るプラスチックは一旦加熱成形させると、再度加熱しても軟化することがないので、熱硬化性プラスチックと呼ばれており、同様の性質を示すプラスチックにはフェノール樹脂、メラミン樹脂、エポオキシ樹脂などがある。これに対して、加熱によって軟化するプラスチックを熱可塑性プラスチックといい、ポリエチレンやポリプロピレン、塩化ビニル、ナイロンなどがある。
尿素樹脂はユリア樹脂ともよばれ、素材が白色であるため、カラフルに着色可能な材料として、食器や電機部品、ボタンなどに多く利用されていた。しかし、尿素樹脂は加熱すると、ホルムアルデヒドを放出する欠点があるため、食器等への利用は減少し、現在では接着剤や電気機器部品、漆器用の成形材料などに年間約33万6千トン(1997年)生産されている。
【観察・実験3】 尿素樹脂の製造
尿素樹脂は前述したように、尿素とホルムアルデヒドの付加重合で製造される。工業的には反応中間物質を目的に応じて処理しているが、この実験では尿素とホルムアルデヒドを酸触媒の下で反応させ、樹脂を製造する。なお、平成12年度に発行された多くの「化学?」の教科書にこの実験は掲載されている。また、樹脂の製造に当たって、色素を用いて着色したり、料理用ぬき型を利用して様々な形の尿素樹脂を製造する試みもなされている10)。
[操 作]
? 尿素3gとホルマリン6mlをアルミはく製の料理用容器に入れ、濃硫酸3滴を加えてよくかき混 ぜ、反応の様子を観察する。なお、この反応中は有害なホルマリン蒸気が発生するので、ドラフ ト内で実施すること。
? 固体の樹脂が得られれば、容器より取り出しよく水洗いして堅さを調べた後、樹脂の一端をバー ナーの炎にかざしてみる。樹脂は軟化せず強く加熱すると、焦げてくる。
7 化粧品としての尿素の利用
近年尿素を含んだ化粧品が話題となっている。尿素を化粧品に配合すると、肌の潤いを保ち荒れた肌を滑らかにするとされている。
皮膚は表皮と真皮、皮下組織の三層からなっている(図3)。一番外側の表皮は厚さ約0.2mmで、外界からの異物の進入を防ぐとともに、体内からの体液の蒸散を防ぐ働きをしている11)。
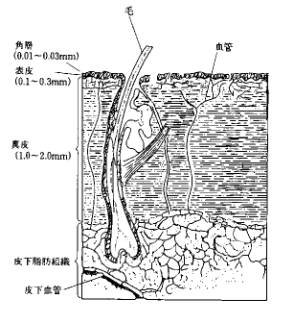 図3 皮膚の構造
図3 皮膚の構造
表皮は皮膚表面から順に角質層、顆粒層、有棘層、基底部の4層に分かれる。角質層は基底部で作られた細胞がつぎつぎと変化しながら4週間かかって、皮膚表面へ押し上げられて角質細胞となったもので 、皮膚表面に約2週間とどまり、皮膚を保護する役割を果たし、やがて、あかやフケとなってはがれ落ちる。このように表皮は常に約6週間の周期で新陳代謝をしている。
角質層は常に10〜20%の水分を含んでいる12)。この角質層に含まれる水分が10%を割ると、皮膚はかさかさしてひび割れる。若々しい皮膚を保つには角質層の水分を 十分に保つ必要がある。角質層はふだん、NMF(NaturalMoisturizing Factor自然保湿因子)と脂質、水分で角質層の水分を逃がさないよう常にバランスをとっている。
尿素は図4のように分極しているため、水分子とは水素結合によって、図5のように結び付く性質があり保水能力が高い。
このため、角質層内のNMFとしての作用があり、水分を保持して肌の乾燥を防ぐ。さらに尿素は肌を構成しているタンパク質のペプチド結合(CO−NH)とも水素結合する。そのため、皮膚表面の角質層と結合して、余分の角質を取り除く作用があり皮膚表面を滑らかにする。
尿素にはこのほかに、細胞を活性化する作用や創傷を治癒させる作用や緩やかな殺菌作用等があるため、化粧品の成分として有用である。
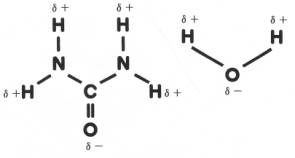
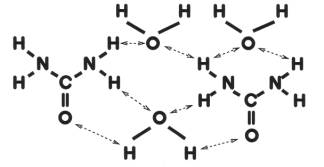
図4 尿素と水の分極 図5 尿素と水の水素結合の模式図
【観察・実験4】 尿素を含んだ化粧水の試作
化粧水の基本的効果は皮膚の一番外側の角質層に作用して、角質の保湿性を保つことにある。したがって、化粧水の基本構成は水と保湿剤としてのグリセリンである。市販品には香料や色素の他に種々の効用を目的として、様々な添加剤が加えられている。最近は添加剤を加えない肌に優しい化粧水作りが、テレビやインターネットで紹介されている。それらの中より、尿素の効果を生かす化粧水の作り方13)を紹介する。
[操 作]
? 尿素50gを200mlの水に溶かす。
? グリセリン5ml(小さじ1杯)を加えよく振る。(化粧水の原液)
? 化粧水として使用するときは?の原液を10倍に薄めて用いる。手始めに手の甲に塗布して、そ の感じを確かめ、異常が無ければ、体の他の部分に使用してもよい。
8 プラスチック製品や建材等からのホルムアルデヒドの放散
尿素樹脂やメラミン樹脂など、ホルムアルデヒドを原料とするプラスチックや接着剤を使用した製品は微量ながら、ホルムアルデヒドを放出する。 近年、新築住宅で目や鼻、のどの痛み、喘息などのアレルギーが発生し、「シックハウス症候群」として問題になっている14)。近年の住宅は快適性・省エネルギー性を高めるために、高気密化・高断熱化されているうえに、さまざまな建材や内装材が使用されている。このため、多種多様な揮発物質が室内に放散されている15)。これらの物質をVOC(Volatile Organic Compound:揮発性有機化合物)と呼び、シックハウス症候群の原因物質として、関係機関で対応が検討されている。このVOCの中で当面優先的に配慮すべき物質として、1)ホルムアルデヒド 2)トルエン 3)キシレン 4)木材保存剤 5)可塑剤 6)防蟻剤が取り上げられている16)。
ホルムアルデヒド(HCHO)は刺激臭のある無色の気体で、空気中に0.2ppm程度存在すると、いわゆる「ホルマリン臭」を感じ、1〜2ppmで刺激による不快感を感じ、高濃度になると表1に示すように、人体に様々な急性障害を引き起こす性質がある。
ホルムアルデヒドはフェノール樹脂、メラミン樹脂、ユリア(尿素)樹脂等のプラスチックの他、接着剤、塗料、防腐・殺菌剤、防皺剤、防ちじみ剤等の原料として広く使用されているため、ホルムアルデヒドを含む製品は合板、集成材、フローリング剤、カーテン、カーペット、断熱材、接着剤、でんぷん糊、食器、衣服、防臭剤、消毒剤、防カビ剤等多種にわたっている。このため個々の製品の放出量は微量であっても、集積されると無視できない量となり、室内のホルムアルデヒド濃度は0.012〜0.12ppmに達する13)。この濃度は東京霞ヶ関の年平均濃度(0.004ppm)の3〜30倍であり、ドイツ、オランダ、スウェーデンが定めている室内の環境基準0.1ppmを上回る場合もあることを示しており、化学物質過敏症の人々だけでなく、無症状の人達にとっても無視できない状況である。しかしながら、現時点では十分な対応策は講じられていない。今後、室内のホルムアルデヒド濃度の環境基準が示され、基準をクリアーできる材料や施工法が導入されると思われるが、それまではホルムアルデヒドが多く含まれている物質をできるだけ使用しないで、室内の換気をよくする等、我々自身で住環境に十分注意する必要がある。
|
気中濃度(ppm) |
影 響 |
|
2 |
臭気を感じるが、すぐに慣れて感じなくなる。 |
|
0.5 |
明らかに臭気を感じる。 |
|
1〜2 |
目・鼻への刺激、不快感を感じる。 |
|
3 |
刺激による苦痛を覚える。 |
|
5〜10 |
目・耳・喉に強い刺激。短時間耐えられる限度 |
|
10〜20 |
涙・咳が出る。深い呼吸は困難。 |
|
50以上 |
5から10分で深部気道障害を招く |
表1 ホルムアルデヒド濃度の人体への影響
多田治 「労働科学叢書25」より転載
【観察・実験5】 樹脂より溶出するホルムアルデヒドの検出
ホルムアルデヒドを原料に使用している物質からは、前述のように、ホルムアルデヒドが排出される。今回はプラスチックより水中に溶出するホルムアルデヒドの検出を行う。
[操 作]
? ユリア(尿素)樹脂、メラニン樹脂等のホルマリンを原料とする樹脂の容器または樹脂片(観察 ・実験3で製作したものを利用してもよい)を用意する。
? プラスチック容器の場合は純水100mlを容器に入れ 、時計皿で蓋をして、ウオータバス上で20 分加熱し、試料溶液とする。プラスチック片の場合はビーカに純水100mlを入れ、その中へプラスチック片を入れて、時計皿で蓋をし、ウオータバス上で20分加熱し試料溶液とする。
? 試料溶液5mlを試験管に取り、シッフ試薬*32mlを加え、10分間放置し色の変化を見る。赤色に変色すればアルデヒドが存在したことを示す。
*3 シッフ試薬:シッフ試薬は赤色の色素である塩基性フクシンを二酸化硫黄で脱色した溶液である。アルデヒドと反応して、深紅色(マゼンダ色)を呈する。ケトンとは反応しない。
[シッフ試薬の調製法]
(1) 0.1gの塩基性フクシン(p-ローザニリン塩酸塩)を100mlの水に溶かした後、4mlの飽和亜硫酸水素ナトリウム水溶液を加える。
(2) 1時間後に2mlの濃塩酸を加える。
○ 今回は定性的な検出法を紹介したが、ホルムアルデヒドを定量的に測定する場合は、アセチル セトンを用いる定量法がある18)。
9 おわりに
現在は多くの化学物質が私達の生活と深くかかわり、これらの物質を抜きにしては快適な生活ができない状態になっている。化学物質は私達の生活を豊かにするために利用されているが、時には、私達に有害な作用をする場合もある。今回取り上げた尿素の関連物質についても、多くの有益な利用法がある一方、使用に際しては自然環境等を損なわないように十分な注意が必要なものがあることを示した。このように、1つの物質を多面的に見ることにより、単なる知識の理解にとどまることなく、調和のとれた科学技術の理解が深められるものと考えている。
引用・参考文献
1)“高等学校学習指導要領解説 理科編 理数編”、文部省(平成11年12月)
2)藤野安彦編:“食品・栄養のための生化学”、産業図書、p51(1996)
3)竹林松二:化学と教育、35、332 (1987)
日本化学会:“化学史・常識を見直す”、講談社(BLUE BACKS)、p135(1988)
4)当時のウェラーについては次の文献に記述されている。
マノロフ著、早川光雄訳:“化学をつくった人びと(上)”、東京図書、p264(1979)
渡辺啓、竹内敬人:“化学史”、東京書籍、p211(1987)
原光雄:“化学を築いた人々”、中央公論社、p186(1973)
5)田村善蔵,由岐英剛:“生化学分析法”、南江堂、p63(1984)
6)斉藤正治:化学と教育、37、636(1989)
7)日根文夫:“無機製造化学”、さんえい出版、p151(1989)
8)中村次雄、佐藤功:“初歩から学ぶプラスチック”、工業調査会、p134(1997)
9)井本稔:“私たちの有機化学”、東海大学出版会、p164(1986)
大津隆行:“高分子合成の化学”、化学同人、p229(1979)
10)臼井豊和:化学と教育、38、720(1990)
11)尾澤達也:“化粧品の科学(ポピュラーサイエンス)”、裳華房、p52(1998)
12)日本化学会:“お化粧と科学”、大日本図書、p8(1993)
13)http://www3.ocn.ne.jp/〜ayatori2/life2/life21.html
14)http://www.maruhi-plywood.co.jp/sickhouse.htm
15)日本化学会:“地球環境と計測化学(化学総説N0.29)”、学会出版センター、p159(1996)
16)吉岡安之:“暮らしに潜む危ない化学物質”、実業出版社、p32(1997)
17)村野雅義:“環境空気の破壊”、情報センター出版局、p79(1989)
18)山手昇:“公害分析指針大気編3-a”、(共立出版)、p63(1972)